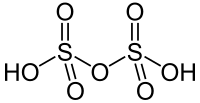
Kemisk formel: H SO 4. Huvudfara: frätande. H och SO det blir svavelsyra. Färglös, starkt vattenupptagande vätska, i vattenlösning en stark syra och världens i volym räknat största industrikemikalie. Fryspunkt: 1°C. Syran kan orsaka kraftiga frätskador.
H2SW4) är en flytande kemisk förening, oljig och färglös, löslig i vatten med värmefrigörande och frätande för metaller och vävnader. Svavelsyra (H2SO4) Formel, Egenskaper, Struktur och Användningar. Karboniserar trä och mest organiska material när det kommer i kontakt med det, men det är osannolikt att det kommer att orsaka brand. Hur går det till när svavelsyra protolyseras i vatten ? Alltså hur ser reaktionsformeln ut i två steg. Avjoniserat vatten speciellt avsett för batterier (batterivatten) ska då fyllas på eftersom det är vattnet i. Det händer när svavelsyran får reagera med kolhydrater, som till exempel socker.
Då drar svavelsyran ut allt vatten (egentligen allt syre och väte) ur kolhydraten, och kvar blir bara en svart pelare av kol. Det blir bara kvar en svart pelare av kol när svavelsyran fått reagera med socker. När en syra lämnar ifrån sig en proton till ett annat ämne, säger man att syran är protolysera eller att syran har protolyserat.
Ett annat sätt att beskriva det på är att syran är deprotonera eller att syran har deprotonerats. Se hela listan på naturvetenskap. Orsaken till detta är att protonövergångar till målmaterialet bryter ned eller gör det mer vattenlösligt.
När man löser en stark syra i vatten avger de flesta syramolekylerna sina protoner till vattnet. Exempel på starka syror: – Väteklorid (saltsyra): HCl. Salpetersyra: HNO3.
Alla dessa syror har i någon mån förmågan att lösa upp metaller. Guld kan exempelvis inte lösas av någon av dessa syror om de bara får verka för sig. Om man däremot blandar saltsyra och salpetersyra resulterar detta i något som kallas för kungsvatten, vilket löser även guld.
Först avges en proton från den starka svavelsyran. Kvar finns sedan en vätesulfatjon, HSO4–vilket är en svag syra, men även en jon. H blir inte lika lågt som om man hade löst en en stark syra i vattnet.
CH3COOH (förkortas ofta HAc, där Ac kommer av engelskans acetic acid). Då protoner försvinner från lösningen så lossnar protoner från den svaga syran, och pH ökar långsammare. Metalljoner kan i många fall fungera som syror. Vad som händer är att metalljonen binder upp vattenmolekyler, och en av dessa släpper ifrån sig en vätejon. För att beskriva hur stark en syra är så använder man sig av något som kallas för syrakonstanten, vilken skrivs som Ka.
På grund av de små värdena minuslogaritmerar man Ka, och pKa ger oss siffror i en omfattning vi enklare kan arbeta med. Mer om detta under titeln ”syrakonstanten” i menyn till vänster. Ju mindre pKa är, ju mer av syran protolyseras (ger ifrån sig protoner).
Det betyder att den innehåller två väteatomer (H), en svavelatom (S) och tre syreatomer (O). Strukturen hos molekylen har svavelatomen i mitten, med de tre syreatomerna bundna till den, varav två är enkelbundna och en av dem är dubbelbunden. När svavelsyra blandas med vatten sker det under kraftig värmeutveckling, vilket kan leda till kokning och därmed sprättande av starkt frätande vätska. Det är därför viktigt att tillämpa SIV-regeln (Syra I Vatten ), alltså inte späda syra genom att hälla på vatten , utan göra vatten surt genom att hälla på syra. Löser du kopparoxid i svavelsyra får du kopparsulfat, när du har avdunstat vattnet som ämnena är lösta i. Kopparsulfat i fast form är kristaller med blå färg.
Dessa kristaller binder vatten. Om du värmer kristallerna avdunstar vattnet och kristllerna intar då en vit färg. Det här är en syra som är starkt frätande och som har den kemiska beteckningen H2SO4.
Den energi som går åt för att bryta de intramolekylära bindningarna i svavelsyramolekylerna är mindre än den som frigörs när bindningarna mellan vattenmolekylerna och svavelsyramolekylerna bildas och det är just det energiöverskottet som blir värme. HCL och 6g vatten. Koncentrerad svavelsyra reagerar snabbt med både organiska och oorganiska ämnen. Den är mycket frätande och kan orsaka stora hål på kläder och liknande om man spiller det på sig.
Liksom saltsyra reagerar svavelsyra med oädla metaller.

Inga kommentarer:
Skicka en kommentar
Obs! Endast bloggmedlemmar kan kommentera.